Intestin poreux, cerveau poreux et troubles neuropsychiatriques

J’ai toujours été très intéressée par les maladies neurologiques et psychiatriques. La recherche sur l’axe microbiote-intestin-cerveau est désormais un sujet ancré dans la littérature et dont les conclusions sont encourageantes pour la compréhension de ces troubles. Malheureusement, leur application en tant qu’agents adjuvants en psychiatrie est loin d’être généralisée. Les prises en charge de la plupart des troubles neuropsychiatriques reposent sur des médicaments. Par exemple, les patients atteints de dépression se voient prescrire des anti-dépresseurs, des anxiolytiques mais quid du microbiote dysbiotique ? de la porosité intestinale ? qui sont pourtant des constats réguliers en consultations et dans les études. Aux USA, certains médecins pratiquent la psychiatrie intégrative, prenant en charge leurs patients dans leur globalité et tenant compte de leur terrain. En France, cela demeure bien trop rare, si ce n’est inexistant. Tout au plus, certains gastro-entérologues se saisissent du sujet, mais pas les psychiatres. Pourtant, le patient aurait tout à gagner d’une fusion de ces compétences, mais pour l’heure, je me suis dit que rédiger un article à ce sujet serait déjà ça de pris, car je reçois régulièrement des questions concernant la connexion possible entre santé intestinale et santé mentale. Je m’en réjouis. Oui ! toutes deux sont intrinsèquement liées, comme des sœurs jumelles.
Quels troubles et maladies seraient concernés ?
- La maladie d’Alzheimer
- Les troubles du spectre autistique (TSA)
- La dépression
- Le trouble bipolaire
- La schizophrénie
- La démence
- L’anxiété
- La maladie de Parkinson
Mais également les migraines et différentes formes d’épilepsie.
La fragilité de deux barrières
Le tractus gastro-intestinal et le cerveau se développent à partir de parties étroitement liées de l'embryon. Ces deux parties ont en commun des barrières vasculaires spécifiques et spécialisées, à savoir la barrière épithéliale intestinale et la barrière hémato-encéphalique (BHE). Le développement de la BHE commence au début de la vie intra-utérine et se poursuit jusqu'aux premiers stades postnatals de la vie. Une bonne formation de la BHE fournit un microenvironnement adéquat pour la croissance et la spécification des neurones. La BHE, lorsqu'elle est intacte, protège contre la colonisation du microbiote au moment crucial du développement cérébral du nouveau-né. Dans la période postnatale, il protège également des métabolites bactériens et de l'exposition à de nouvelles molécules lors du basculement métabolique (lorsque la dépendance aux glucides passe au catabolisme des acides gras). Ce contrôle du passage et des échanges de nutriments et de particules entre le sang et le cerveau assure l'homéostasie du système nerveux central (SNC). Le microbiote peut affecter la perméabilité à la BHE chez les souris fœtales et adultes.
La barrière intestinale
Le terme de « intestin poreux » désigne le fait que la barrière intestinale est devenue perméable. Vulgairement, elle fuit. Il ne s'agit pas d'une maladie ou d'une affection en soi. C'est un symptôme d'inflammation et de déséquilibre qui a de nombreuses causes. La liste des problèmes de santé associés à une perméabilité intestinale est de plus en plus importante, à mesure que la recherche fait du lien et s’intéresse au microbiote.
Notre intestin grêle a une fonction double :
- Absorber les nutriments que nous consommons (acides aminés, acides gras, vitamines…)
- Empêcher les molécules indésirables de passer (microbes, particules alimentaires, produits chimiques…)
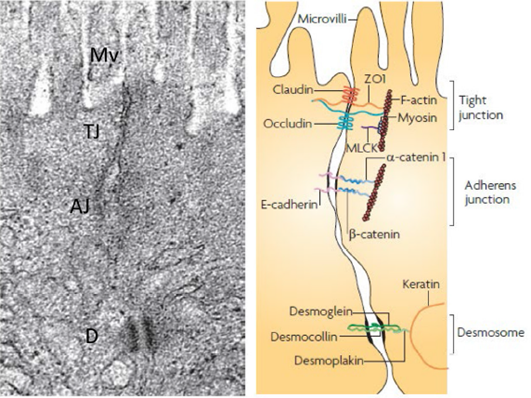
Notre épithélium intestinal (schématisé ci-dessous) se renouvelle très rapidement et efficacement, mais ce renouvellement doit être finement orchestré par l’organisme, sous peine de créer un déséquilibre.
La monocouche épithéliale intestinale est composée de différents types de cellules épithéliales spécialisées :
- Les entérocytes : le type de cellules le plus abondant et dont le rôle principal est le maintien de l’intégrité de la barrière intestinale
- Les cellules de Paneth : situées à la base des cryptes intestinales, ces cellules sécrètent des peptides antimicrobiens pour empêcher l’entrée de micro-organismes (ex : alpha-défensine)
- Les cellules caliciformes : cellules spécialisées dans la sécrétion de peptides muqueux, la défense et la réparation de la couche épithéliale. Elles jouent un rôle important dans l’homéostasie épithéliale
- Les cellules M (microfold) : cellules sécrétrices d’immunoglobulines A (IgA) et aussi cellules présentatrices d’antigènes bactériens auprès des cellules dendritiques (plaques de Peyer)
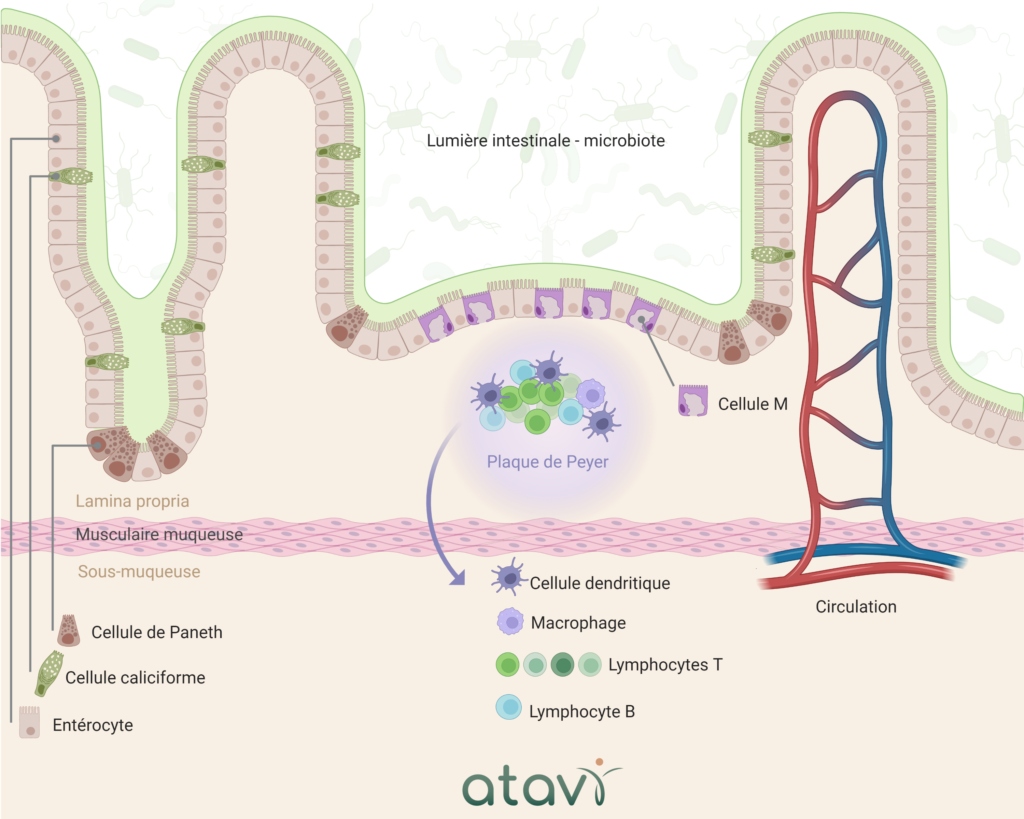
Collectivement, ces cellules forment une barrière normalement imperméable grâce aux jonctions serrées intracellulaires, aux jonctions adhérentes et aux desmosomes. Également, derrière patrouillent de nombreuses cellules immunitaires, prêtes à agir à la moindre introduction anormale (plaque de Peyer).
Il a donc une fonction de barrière protectrice, afin que les particules nocives pour nous ne puissent pas accéder à notre milieu intérieur (car la lumière intestinale demeure le milieu extérieur). L’intégrité et la fonctionnalité de notre paroi intestinale dépendent des molécules telles que la zonuline (découverte par le Dr Allesio Fasano et son équipe de recherche), l'occludine, la claudine 1, la E-cadhérine, JAM-1, les caténines, la cinguline et l'actine : c’est ce que l’on appelle les jonctions serrées et adhérentes.
Normalement, les entérocytes sont reliés entre eux par ces jonctions intercellulaires, qui empêchent les grosses molécules de passer dans la circulation sanguine. Les jonctions s'ouvrent sélectivement pour laisser passer certaines molécules, mais elles restent principalement fermées. Lorsque les jonctions sont enflammées ou dysfonctionnelles, elles se relâchent et les grosses molécules passent. Les substances qui passent par les jonctions intracellulaires sont considérées par notre système immunitaire comme étrangères, ce qui stimule une réaction du immunitaire.
Qu'est-ce qui peut perturber l'épithélium intestinal ?
L’intégrité de la couche épithéliale intestinale est une priorité pour qu’elle demeure fonctionnelle, qu’elle puisse continuer à remplir ses rôles. Également, la bonne santé du microbiote intestinal est de mise. Des milliards de bactéries commensales résident dans notre lumière intestinal et jouent un rôle vital dans la digestion et le développement du système immunitaire.
C’est une perpétuelle adaptation qui se joue entre nos cellules épithéliales intestinales (CEI), nos cellules immunitaires et notre flore, afin de nous protéger. Les CEI captent les changements du microbiote et signalent aux cellules immunitaires de s’adapter et d’intégrer les nouvelles informations. Malheureusement, des signaux négatifs sont également intégrés, et peuvent déclencher une réaction du système immunitaire anarchique (ex : maladies auto-immunes) et une inflammation systémique (généralisée). Ce schéma récapitule les coupables rencontrés et les conséquences :

La barrière hémato-encéphalique (BHE)
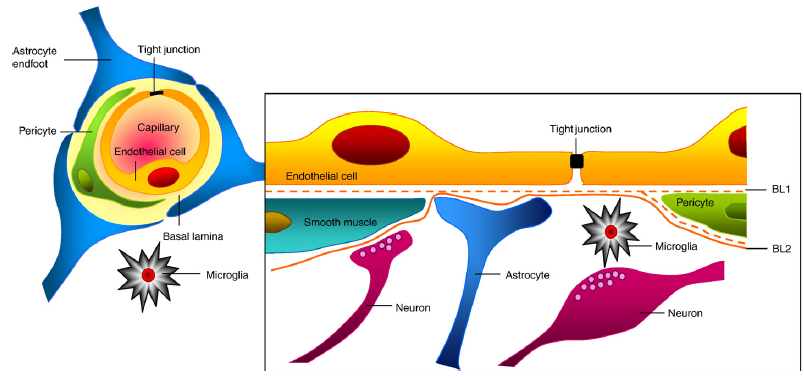
La BHE est constituée de cellules endothéliales capillaires, qui forment ce que l’on nomme « l’unité neurovasculaire » et qui comprend également les neurones, la matrice extracellulaire, les péricytes et astrocytes. Ces cellules endothéliales capillaires sont reliées par des jonctions serrées intracellulaires et ces dernières contrôlent le passage des substances présentes dans le sang vers le cerveau. Grâce à elles, l’équilibre du SNC est maintenu, dans des conditions homéostasiques. Mais ! Le microbiote peut affecter la perméabilité de la BHE, à l’image de la barrière intestinale.
Récemment, quelques études ont suggéré que le microbiote peut affecter directement le cerveau et l'intestin de plusieurs manières. Avec les protéines de transport sélectives, la BHE permet aux nutriments, à l'oxygène, aux acides aminés, à certains médicaments et au glucose de pénétrer dans le liquide céphalo-rachidien (LCR) et empêchent les autres. Dans le même temps, il permet la diffusion de nombreuses petites molécules polaires, de gaz dissous, d'hormones et des molécules hydrophiles. Comme les barrières partagent des protéines et caractéristiques communes, il ne fait aucun doute qu'elles peuvent être sensibles à des mécanismes similaires de violation, qu'ils soient biochimiques ou physiques, ce qui soutient l’hypothèse d'un syndrome plausible intestin perméable/cerveau perméable.
Problème : le cerveau est un organe extrêmement gras, environ 60 %. C’est le second organe le plus riche en graisses, après le tissu adipeux. Cette information est capitale : la plupart des toxines sont lipophiles. Autrement dit, le risque d’accumulation cérébrale serait très grand s’il n’existait pas de frontière fonctionnelle.
L'affaiblissement de la BHE peut être le résultat d'une perturbation des cellules endothéliales due à un dysfonctionnement de la P-glycoprotéine. Les neurones peuvent influencer la perméabilité, tout comme la matrice extracellulaire et les cellules non neuronales, notamment les astrocytes, péricytes et les cellules endothéliales vasculaires.
La communication bidirectionnelle nommée « axe microbiote-intestin-cerveau »
Voie neurale
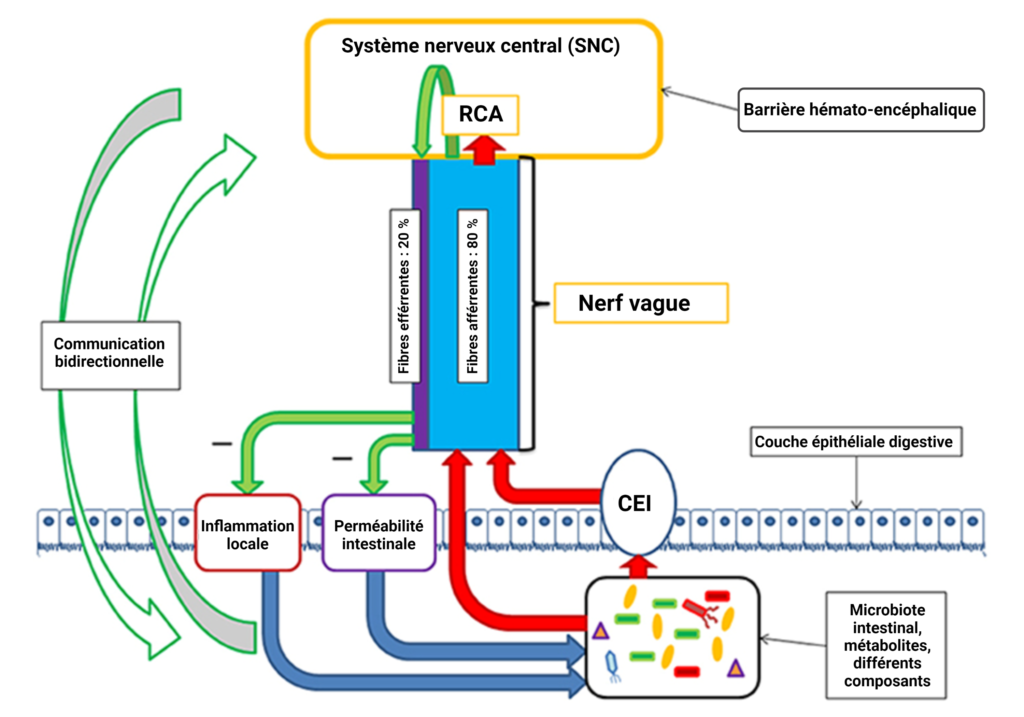
Le nerf vague : l'autoroute qui relie deux mondes
Le nerf vague, dixième nerf crânien et acteur principal du système nerveux parasympathique (SNP), part du tronc cérébral jusqu’à l’abdomen et participe à de nombreuses fonctions, dont notre digestion. Son neurotransmetteur « maître » est l’acétylcholine (ACh), qui stimule entres autres les contractions musculaires du SNP via les récepteurs nicotiniques et muscariniques. Ses fibres nerveuses sont réparties comme suit :
- 80% conduisent les informations partant du corps vers le cerveau (fibres afférentes)
- 20% acheminent les infos provenant du cerveau jusqu’aux organes (fibres efférentes)
Le système nerveux entérique (SNE)
Il s’agit de celui que l’on nomme « deuxième cerveau » à juste titre : un réseau électrique propre à l’intestin, et très similaire dans sa structure et fonctionnement. Le SNE est constitué de deux plexus :
- Le plexus sous-muqueux ou plexus de Meissner (régule le flux sanguin gastro-intestinal, contrôle les fonctions et la sécrétion des cellules épithéliales)
- Le plexus myentérique ou plexus d’Auerbach (régule la relaxation/contraction de la paroi intestinale → péristaltisme)
Il règne sur la sphère digestive, orchestre ses fonctions et communique avec le nerf vague via l’activation cholinergique (récepteurs nicotiniques). Les neurones du SNE sont en relation étroite avec les cellules du système immunitaire adaptatif et inné et régulent leurs fonctions et activités. Le SNE produit plus de 30 neurotransmetteurs (hormones, peptides) et peut les libérer dans la circulation sanguine. Ces éléments traverseront la BHE pour apporter des informations au cerveau, soutenus par le nerf vague qui travaille en parallèle.
Voie immunitaire
Les cellules du système immunitaire, largement présentes au niveau de l’intestin comme nous l’avons vu précédemment, sont capables de générer des molécules pro-inflammatoires qui rejoignent la circulation sanguine et peuvent atteindre le cerveau (→ neuroinflammation). Par exemple, il a été observé que des patients atteints de trouble dépressif majeur (TDM), de trouble bipolaire et de schizophrénie avaient des taux de cytokines pro-inflammatoires dans le sang élevés, ainsi que d’autres marqueurs comme la protéine C-réactive. L’observation était d’ailleurs similaire dans le liquide céphalo-rachidien.
Notre système immunitaire a la capacité de reconnaitre des éléments indésirables grâce à des récepteurs spécifiques (TLR : Toll-Like Receptors). Cette détection induit une cascade de signalisations pour produire des médiateurs pro-inflammatoires :
- Les cytokines
- Les chimiokines
- Les peptides antimicrobiens
afin de les éliminer. Toutefois, cette inflammation locale, si persistante, peut induire une perméabilité de la BHE→ activation des cellules microgliales.
Voie métabolique
Selon la composition du microbiote, les neurotransmetteurs, leur métabolisme et leur synthèse peuvent être modulés, et donc, nos émotions et notre comportement également. Voici des exemples :
- Candida, Escherichia, Enterococcus et Streptococcus peuvent produire de la sérotonine
- Bifidobacterium et Lactobacillus produisent du GABA
- Lactobacillus : acétylcholine
- Bacillus et Serratia : dopamine
- Escherichia et Saccharomyces : noradrénaline
Cette production est censée agir principalement localement, sur le SNE. Mais ce peut être suffisant : le microbiote intestinal peut moduler l’activité sérotoninergique, dopaminergique, noradrénergique, glutamatergique et gabaminergique, et l'on sait que l’altération du métabolisme des neurotransmetteurs est un facteur pour de nombreuses pathologiques neuropsychiatriques. Aussi, la sérotonine peut être consommée par des bactéries et parasites et donc, toute dysbiose ou parasitose sera une potentielle menace pour la santé mentale.
Voie endocrinienne
Il a été démontré qu'une exposition chronique à des cytokines inflammatoires élevées peut entraîner une dépression. Un axe hypothalamo-hypophyso-surrénalien (HHS) surstimulé est le plus souvent observé chez les sujets souffrant de dépression plus sévère (c'est-à-dire mélancolique ou psychotique), lorsque les mécanismes inhibiteurs de la rétroaction du cortisol sont altérés, contribuant à la sursécrétion de cytokines. Cela pourrait s'expliquer par le fait que la surexpression des cytokines entraîne une réduction des niveaux de sérotonine. Dans cette optique, le traitement avec des agents anti-inflammatoires a le potentiel de réduire les symptômes dépressifs. Les maladies inflammatoires intestinales (MII) sont donc un facteur de risque important pour les troubles de l'humeur et l'anxiété, et ces troubles psychiatriques augmentent le risque d'exacerbation des MII.
Un stress important, de toute nature, va induire une grande production de cytokines pro-inflammatoires. Ces niveaux élevés et chroniques de cytokines activent en permanence le système limbique, un centre cérébral responsable de nos émotions et de notre comportement. En réponse, vont être stimulés l’hypothalamus (corticotrophine), puis l’hypophyse (ACTH) et les glandes surrénales pour produire et sécréter du cortisol, l’hormone reine du stress qui possède de grands effets anti-inflammatoires et immunosuppresseurs. Le cortisol agit sur plusieurs organes, dont le cerveau. Et inversement, le cerveau indiquera au nerf vague (fibres efférentes) de devenir hypotonique et de sécréter de l’acétylcholine pour inhiber les cytokines inflammatoires au niveau intestinal. Donc oui ! Un cercle bien vicieux…
Maintenant que nous avons parlé des mécanismes impliqués, j'aborde les thérapies adjuvantes en psychiatrie intégrative.
Travailler la détente, bien-être et système nerveux
La stimulation vagale
La stimulation vagale, ou stimulation neuro-vagale (SNV), est un procédé d’électrostimulation auriculaire, qui envoie de petites impulsions électriques non invasives. L’utilisation de la stimulation vagale a été approuvée par la FDA en 1997 pour accompagner les soins prodigués aux personnes souffrant d’épilepsie pharmaco-résistante et de dépression, à partir de 12 ans. Cette thérapie donne de bons résultats et la recherche tente désormais de savoir si elle pourrait bénéficier à d’autres soucis de santé.
En effet, comme expliqué dans mon précédent article, le nerf vague a des propriétés anti-inflammatoires (↓ cytokines). Son activation permettrait de réduire la neuroinflammation qui entretient des troubles tels que la fibromyalgie, les migraines, polyarthrite rhumatoïde mais aussi les MICI, gastroparésie… In fine, toute maladie pouvant bénéficier de la neuromodulation, et il y en aurait beaucoup. Toutefois, il faut noter que les effets prennent du temps à survenir (de plusieurs mois, jusqu’à 2-3 ans) car la SNV est comme un entrainement sportif du nerf vague, qui deviendra plus tonique et efficace au fil du temps.
Les appareils de l’entreprise spécialisée Schwa-medico sont recommandés par les médecins. Actuellement en France il n’existe pas de remboursement pour un tel appareil. Il est toutefois recommandé d’apprendre à l’utiliser auprès de son médecin prescripteur pour connaitre la fréquence adaptée.
Également, le neurofeedback semblerait intéressant pour la dépression et l’anxiété. Des professionnels formés existent en France.
Méthodes de relaxation
Ça peut paraître cliché d’indiquer à une personne dépressive de se mettre à la méditation ou au yoga, et pourtant… Les effets sont bien là. Etant donné que la fonction vagale est directement reliée à notre réponse face au stress, un travail profond sur ces mêmes causes qui stressent l’individu permet assurément une atténuation des symptômes. En particulier, les thérapies centrées sur la respiration sont très pertinentes. Voici des outils recommandés :
- Méditation
- Yoga doux
- Cohérence cardiaque
- Respiration profonde, diaphragmatique
- Sophrologie
Toutes les formes de stress mettent l’organisme sur le mode sympathique du système nerveux, un contexte plutôt pro-inflammatoire et non favorable à un intestin et microbiote en bonne santé (et nous avons vu l’importance de leur intégrité dans l’article précédent). Dans des conditions normales, un stress provoque l’activation du système nerveux sympathique et une cascade de réactions pro-inflammatoires. Ces éléments sont nécessaires à un instant T, mais ne devraient pas être chroniques car le système parasympathique ne peut plus reprendre sa place (charge allostatique).
Aussi, la pratique de l’hypnose et les thérapies cognitivo-comportementales peuvent donner de bons résultats, associées aux autres mesures.
La modulation du microbiote intestinal
Comment module-t-on en première intention le microbiote intestinal ?
Par l’alimentation ! Un levier super puissant et jamais abordé en consultation de psychiatrie. Voyons donc les possibilités.
Les acides gras essentiels
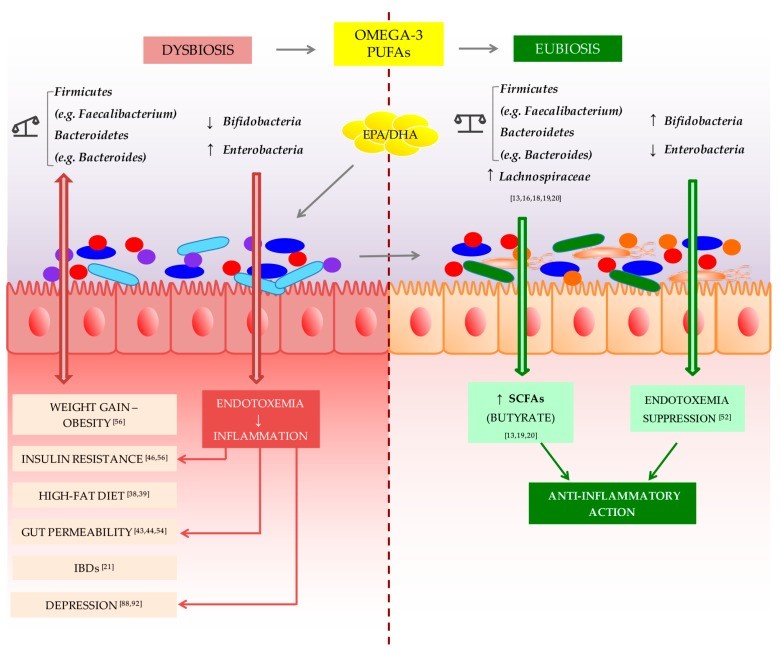
Les oméga 3 (EPA, DHA) et oméga 6 (acide arachidonique) sont des éléments très importants dans le maintien de l’intégrité et fonction du système nerveux et système immunitaire. En particulier, les AGPI oméga 3 agissent directement sur la neurotransmission et expression génétique. Le DHA affecterait également l’écosystème intestinal dans sa structure et fonctions.
Leur supplémentation aurait un effet positif sur la réduction des symptômes de ces maladies. Les dernières données suggèrent que les AGPI oméga 3 modulent la composition du microbiote intestinal et aident à la normaliser après avoir perturbé le stress environnemental.
Les acides gras à chaine courte (AGCC)
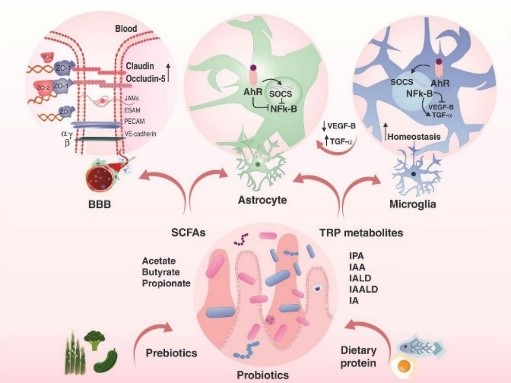
Actuellement, les AGCC sont considérés comme des médiateurs dans l'intestin et le cerveau en raison de leur rôle neuroactif, anti-inflammatoire et de leurs effets bénéfiques sur la santé du cerveau. Les fibres solubles, les protéines et les peptides, qui ne sont pas dégradés dans la partie supérieure de l'intestin par les enzymes digestives, sont métabolisés par le microbiote intestinal dans le caecum et le côlon. Leurs principaux produits sont les AGCC, notamment l'acétate, le propionate et le butyrate. Le butyrate est la principale source d'énergie des colonocytes et protège contre l'inflammation. L'acétate et le propionate peuvent aussi moduler l'inflammation ; ils augmentent également la production de certains peptides qui affectent la satiété et le transit intestinal.
Les AGCC régulent également la perméabilité de la BHE. Dans une étude préclinique, la colonisation de souris sans germes avec Clostridium tyrobutyricum (un producteur de butyrate) ou avec Bacteroides thetaiotaomicron (un producteur d'acétate et de propionate) a diminué la perméabilité de la BHE et a été associée à une expression accrue de la protéine occludine dans le cortex frontal et l'hypothalamus. Dans un modèle animal, l'administration intrapéritonéale et intraveineuse de butyrate de sodium a empêché la dégradation de la BHE et favorisé l'angiogenèse et la neurogenèse.
AGCC et métabolites du tryptophane
Précédemment, nous avons parlé de la neuroinflammation qui caractérise la plupart des maladies neuropsychiatriques. Elle résulte de l'activation des cellules microgliales et de la présence de leucocytes infiltrants périphériques dans le parenchyme du SNC. Lorsque les cellules microgliales sont en homéostasie, elles ne produisent pas de médiateurs pro-inflammatoires. Par conséquent, il n'y a pas de cellules immunitaires périphériques infiltrantes dans le cerveau et il n'y a pas de neuroinflammation. Les AGCC et les métabolites du tryptophane peuvent empêcher l'activation des astrocytes et des cellules microgliales en bloquant les facteurs de transcription pro-inflammatoires, ce qui conduit à l'homéostasie dans le cerveau.
Sport
La pratique d’une activité physique régulière offre de nombreux avantages pour la santé, et se révèle une bonne stratégie pour réguler les réponses physiologiques de l’organisme face au stress. Il a été démontré que le sport module la flore intestinale dans le bon sens. Lorsque l’on compare le microbiote d’athlètes professionnels à celui de personnes sédentaires, les sportifs présentent une flore plus riche en AGCC, AGCC qui sont augmentés au cours de l’exercice physique.
Pathologies neuropsychiatriques
Dépression et anxiété
Une revue parapluie (juillet 2022) a mis à mal l’hypothèse selon laquelle la dépression résulterait d'un déséquilibre de la sérotonine (faisant de fait voler en éclats l’utilisation des IRSS). Voici un extrait :
Notre examen complet des principaux volets de la recherche sur la sérotonine montre qu'il n'y a aucune preuve convaincante que la dépression soit associée ou causée par des concentrations ou une activité de sérotonine plus faibles. La plupart des études n'ont trouvé aucune preuve d'une réduction de l'activité de la sérotonine chez les personnes souffrant de dépression par rapport aux personnes sans dépression, et les méthodes visant à réduire la disponibilité de la sérotonine en utilisant la déplétion en tryptophane n'abaissent pas systématiquement l'humeur des volontaires. (…) Cette revue suggère que l'énorme effort de recherche basé sur l'hypothèse de la sérotonine n'a pas produit de preuves convaincantes d'une base biochimique à la dépression. Ceci est cohérent avec la recherche sur de nombreux autres marqueurs biologiques. Nous suggérons qu'il est temps de reconnaître que la théorie de la dépression fondée sur la sérotonine n'est pas étayée empiriquement.
Ceci explique bien pourquoi si peu de personnes atteintes de dépression chronique ne voient pas leur maladie résolue. Ils se sentent plutôt ensuqués mais ça ne règle pas le problème. Que peut-on faire ?
Deux probiotiques semblent se démarquer en tant que thérapie adjuvante contre la dépression :
- Lactobacillus helveticus Rosell®-52
- Bifidobacterium longum Rosell®-175
D’ailleurs, le laboratoire pionnier qui commercialise leur association, Lallemand, a déposé le brevet CEREBIOME®. Il s’agit du premier et unique psychobiotique approuvé par les autorités (au Brésil et Canada) dans le traitement de la dépression et anxiété. Dans une étude pilote récente de 2021, 10 participants dépressifs ont reçu ce psychobiotique (3x109 CFU) durant 8 semaines. Ils ont noté des « améliorations significatives des symptômes cliniques affectifs » dès la 4e semaine, effets qui se sont maintenus à la 8e semaine. Le sommeil était aussi meilleur et aucun effet secondaire n’a été relevé.
Maladie d’Alzheimer
Plusieurs études ont suggéré que les agents infectieux pourraient être des facteurs déclenchants dans l’étiopathogénie de la maladie d’Alzheimer (virus, bactéries, champignons, parasites).
Une étude randomisée en double aveugle de 2019 a présenté des résultats encourageants dans la prise en charge d’Alzheimer. Grâce à une supplémentation de probiotiques, B.longum et Lactobacillus spp, en association avec du sélénium durant 12 semaines, les personnes souffrant d’Alzheimer ont eu une amélioration de leurs fonctions cognitives et métaboliques, ainsi qu’une réduction du stress oxydatif et des anomalies métaboliques (glycémie et lipides sanguins) par rapport au groupe prenant uniquement du sélénium et groupe contrôle
TSA (trouble du spectre autistique)
Beaucoup d’enfants et adultes atteints du TSA présentent généralement des symptômes digestifs. Le lien étroit avec la sphère digestive est assez évident par la clinique. Plus l’autisme est sévère, plus les symptômes gastro-intestinaux le sont : diarrhée, constipation sont très courants et s’alternent généralement. Les enfants autistes présentent une flore plus pauvre en bactéries fermentatives comme Prevotella copri, ils produisent donc bien moins d’AGCC, et ont globalement une flore plus pauvre.
Chercheur clé dans ce domaine, le Dr James B. Adams a réalisé avec ses collègues en 2017 un essai clinique ouvert avec 18 enfants (7 à 16 ans), comparativement à 20 enfants neurotypiques non traités. L’étude a duré 18 semaines :
- Administration d’un antibiotique (Vancomycine orale) durant 14 jours : pour éliminer les bactéries pathogènes
- Administration d’un IPP (Prilosec) au 12e jour d’antibiothérapie : pour réduire l’acidité gastrique et augmenter les chances de survie du SHGM
- Au jour 15 : MoviPrep + 1 jour de jeûne afin de laver les intestins d’éventuels résidus microbiens et de l’antibiotique
- Jour 16 : administration d’une haute dose de SHGM (Standardized Human Gut Microbiota) 2,5x1012 par voie orale ou rectale en première phase
- En seconde phase, une dose plus faible de 2,5x109 comme entretien les 8 dernières semaines
La transplantation fécale de sujets sains à permis de réduire chez les enfants atteints de TSA jusqu’à 80% de leurs symptômes gastro-intestinaux. Aussi, les symptômes comportementaux se sont améliorés et ont été conservés 8 semaines après le traitement. Fait prometteur : deux années après la TMF, la plupart des améliorations persistaient.
Les auteurs reconnaissent bien la problématique d’un essai ouvert et suggèrent d’approfondir cette piste avec des essais randomisés, en double aveugle et contrôlés par placebo, étant donné ces résultats encourageants.
Trouble bipolaire
Pour le trouble bipolaire, la recherche est plus compliquée, très certainement en raison de l’hétérogénéité des formes de bipolarité et de la complexité du microbiote associé. Toutefois, une revue systématique récente (2022) a conclu :
L'apport alimentaire ou la supplémentation en acides gras insaturés, principalement en oméga-3, semble être associé à une amélioration des symptômes du trouble bipolaire, ainsi qu'avec les fruits de mer, l'acide folique et le zinc. Des études ont révélé des effets variables, principalement non significatifs, de la supplémentation en créatine, carnitine, vitamine D, inositol ou NAC sur la bipolarité. Il existe des résultats prometteurs associés à la coenzyme Q10 (Coq10) et aux probiotiques. Pris ensemble, ces résultats préliminaires suggèrent que des approches diététiques pourraient être incluses dans le cadre de son traitement. Compte tenu également du risque élevé de troubles métaboliques chez les personnes atteintes de bipolarité, elles devraient être encouragées à choisir des modes de vie alimentaires sains, y compris la consommation quotidienne de fruits, de légumes, de fruits de mer et de grains entiers.
Pourquoi le CoQ10 semble si intéressant pour le trouble bipolaire ? Une hypothèse serait que la bipolarité résulterait d’un trouble du complexe PDH (pyruvate déshydrogénase) et donc, d’une altération du métabolisme énergétique. L’association d’une alimentation cétogène donne de bons résultats.
Maladie de Parkinson
En 2015, Scheperjans et son équipe ont analysé le microbiote de 72 patients atteints de la maladie de Parkinson comparativement à celui de 72 sujets sains. Leur analyse du microbiote fécal des malades de Parkinson a permis de mettre en évidence un fort lien entre la maladie et l’axe microbiote-intestin-cerveau. Les patients présentaient :
- Une diminution des Prevotellaceae de 77,6 %
- Une abondance des Enterobacteriaceae (corrélée à l’instabilité posturale et difficultés à marcher)
Les malades de Parkinson semblent souffrir d’une dysbiose intestinale importante qui altère leur système nerveux entièrement. Des taux sanguins réduits de LPB (lipoprotein binding protein) sont détectés alors que ceux de LPS sont élevés.
Dans un essai clinique contrôlé par placebo, des patients atteints de la maladie de Parkinson ont été traités avec des probiotiques (Lactobacillus acidophilus , B. bifidum , L. reuteri et Lactobacillus fermentum) et l'échelle d'évaluation unifiée de la maladie de Parkinson de la Movement Disorders Society a été administrée avant et après l'intervention. Par rapport au placebo, le traitement probiotique a diminué les scores de l'échelle d'évaluation de la maladie de Parkinson, réduit la protéine C-réactive ultra- sensible, diminué les dommages oxydatifs et augmenté la défense enzymatique.
Schizophrénie
Les personnes atteintes de schizophrénie présenteraient un microbiote altéré avec :
- des niveaux inférieurs du phylum Proteobacteria, Haemophilus spp, Sutterella spp, Clostridium spp par rapport aux groupes témoins,
- mais des niveaux plus élevés du genre Anaerococcus.
Dans un essai, les patients (60) ont reçu une co-supplémentation de vitamine D (50 000 UI toutes les deux semaines) et probiotiques (8 × 109 UFC/jour de Lactobacillus acidophilus, Bifidobacterium bifidum, Lactobacillus reuteri et Lactobacillus fermentum) durant 12 semaines, contre placebo, pour évaluer l’effet clinique sur la schizophrénie chronique, à la lumière du score PANSS. L’essai a révélé :
- une amélioration significative du score PANSS (amélioration des symptômes)
- une meilleure capacité antioxydante et diminution du malondialdéhyde (marqueur du stress oxydatif)
- une diminution de la protéine-C-réactive ultra-sensible
Dans une autre étude pilote, les chercheurs ont travaillé sur le lien entre Candida et incidence de la schizophrénie. Cette étude a conclu :
- que des niveaux élevés d’anticorps anti-candida sont abaissés par les probiotiques
- que les probiotiques soulagent les inconforts digestifs dont souffrent souvent les schizophrènes
- que la séropositivité à Candida albicans est associée à une aggravation des symptômes psychiatriques
Toutefois, ces effets concernés les sujets masculins. Pour eux, le traitement probiotique a permis de normaliser les niveaux d’anticorps anti-candida, les troubles digestifs, indiquant une direction positive prise par la flore commensale.
Conclusion
Quelle pourrait être ma conclusion finale pour clore ce grand article ?
Que la complexité des maladies neuropsychiatriques n’est pas aisée à dompter, il reste un sacré bout de chemin à effectuer. Toutefois, avec l’émergence de la recherche sur le microbiote (très récente dans l’histoire de la science), je pense que l’on tient quelque chose. Le fait est que notre flore intestinale semble avoir un impact sur à peu près tous nos différents systèmes, y compris notre expression génétique. Donc, une personne prédisposée/à risque d’une maladie neuropsychiatrique peut voir comme élément déclencheur sa dysbiose intestinale et syndrome de porosité intestinale.
Certains auteurs avancent dans leurs recherches que les maladies psychiatriques pourraient grandement bénéficier d’une prise en charge incluant un travail sur le nerf vague, associé à l’administration de probiotiques spécifiques, voire carrément d’une transplantation de microbiote fécal (les études sur l’autisme en sont un bon exemple).
Mais il est important d’envisager le problème dans sa globalité. Par exemple, le syndrome de stress post-traumatique (SSPT) survient après un évènement traumatisant, qui laisse une trace profonde dans le cerveau de l’individu. Cet évènement « s’ancre » et modifie en profondeur le fonctionnement du cerveau et du système nerveux, constamment actionnés sur le mode du stress, du combat et de la fuite. Ce type d’impact a, à coup sûr, des répercussions sur la sphère digestive (communication bidirectionnelle, n’oublions pas). C’est pourquoi la prise en charge devrait à mon sens associer une psychothérapie adaptée, avec une intervention nutritionnelle et un travail « physique » avec le nerf vague (chiropracteur, kiné spécialisé, neurofeedback, acupuncture, thérapie de stimulation du NV…). Cette trithérapie permet d’assurer au patient une intervention globale et fonctionnelle de sa problématique.
Prendre en charge un trouble psychiatrique n’est jamais aussi simple que d’administrer un probiotique ou un complément alimentaire. La diète l’emporte toujours, nettement supérieure, car la modulation du microbiote est plus complète. Dans ma pratique, j’ai beaucoup utilisé l’alimentation cétogène pour prendre en charge nutritionnellement les patients souffrants de tels troubles. La plupart du temps, les symptômes digestifs étaient améliorés. Pour la cognition, c’était au cas par cas, il faut tester avec un suivi personnalisé !
Une chose est sûre, l’intestin est réellement notre deuxième cerveau 🦠
Sources :
Lipski, Elizabeth. Digestive Wellness: Strengthen the Immune System and Prevent Disease Through Healthy Digestion, Fifth Edition . McGraw-Hill Education.
Camilleri, Michael. “Leaky gut: mechanisms, measurement and clinical implications in humans.” Gut vol. 68,8 (2019): 1516-1526. doi:10.1136/gutjnl-2019-318427
Chelakkot, C., Ghim, J. & Ryu, S.H. Mechanisms regulating intestinal barrier integrity and its pathological implications. Exp Mol Med 50, 1–9 (2018). doi.org/10.1038/s12276-018-0126-x
Bonaz, Bruno et al. “The Vagus Nerve at the Interface of the Microbiota-Gut-Brain Axis.” Frontiers in neuroscience vol. 12 49. 7 Feb. 2018, doi:10.3389/fnins.2018.00049
Breit, Sigrid et al. “Vagus Nerve as Modulator of the Brain-Gut Axis in Psychiatric and Inflammatory Disorders.” Frontiers in psychiatry vol. 9 44. 13 Mar. 2018, doi:10.3389/fpsyt.2018.00044
Wolburg, Hartwig, and Andrea Lippoldt. “Tight junctions of the blood-brain barrier: development, composition and regulation.” Vascular pharmacology vol. 38,6 (2002): 323-37. doi:10.1016/s1537-1891(02)00200-8
Socała, Katarzyna et al. “The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders.” Pharmacological research vol. 172 (2021): 105840. doi:10.1016/j.phrs.2021.105840
Generoso, Jaqueline S et al. “The role of the microbiota-gut-brain axis in neuropsychiatric disorders.” Revista brasileira de psiquiatria (Sao Paulo, Brazil : 1999) vol. 43,3 (2021): 293-305. doi:10.1590/1516-4446-2020-0987
Johnson, Rhaya L, and Christopher G Wilson. “A review of vagus nerve stimulation as a therapeutic intervention.” Journal of inflammation research vol. 11 203-213. 16 May. 2018, doi:10.2147/JIR.S163248
Generoso, Jaqueline S et al. “The role of the microbiota-gut-brain axis in neuropsychiatric disorders.” Revista brasileira de psiquiatria (Sao Paulo, Brazil : 1999) vol. 43,3 (2021): 293-305. doi:10.1590/1516-4446-2020-0987
Costantini, Lara et al. “Impact of Omega-3 Fatty Acids on the Gut Microbiota.” International journal of molecular sciences vol. 18,12 2645. 7 Dec. 2017, doi:10.3390/ijms18122645
Socała, Katarzyna et al. “The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders.” Pharmacological research vol. 172 (2021): 105840. doi:10.1016/j.phrs.2021.105840
Barton, Wiley et al. “The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level.” Gut vol. 67,4 (2018): 625-633. doi:10.1136/gutjnl-2016-313627
Moncrieff, J., Cooper, R.E., Stockmann, T. et al. The serotonin theory of depression: a systematic umbrella review of the evidence. Mol Psychiatry (2022). Doi :10.1038/s41380-022-01661-0
Wallace, Caroline J K, and Roumen V Milev. “The Efficacy, Safety, and Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study.” Frontiers in psychiatry vol. 12 618279. 15 Feb. 2021, doi :10.3389/fpsyt.2021.618279
Tamtaji, Omid Reza et al. “Probiotic and selenium co-supplementation, and the effects on clinical, metabolic and genetic status in Alzheimer's disease: A randomized, double-blind, controlled trial.” Clinical nutrition (Edinburgh, Scotland) vol. 38,6 (2019): 2569-2575. doi: 10.1016/j.clnu.2018.11.034
Kang, Dae-Wook et al. “Microbiota Transfer Therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study.” Microbiome vol. 5,1 10. 23 Jan. 2017, doi:10.1186/s40168-016-0225-7
Gabriel, Fernanda C et al. “Nutrition and bipolar disorder: a systematic review.” Nutritional neuroscience, 1-15. 24 May. 2022, doi:10.1080/1028415X.2022.2077031
Campbell, Iain, and Harry Campbell. “A pyruvate dehydrogenase complex disorder hypothesis for bipolar disorder.” Medical hypotheses vol. 130 (2019): 109263. doi:10.1016/j.mehy.2019.109263
Scheperjans, Filip et al. “Gut microbiota are related to Parkinson's disease and clinical phenotype.” Movement disorders : official journal of the Movement Disorder Society vol. 30,3 (2015): 350-8. doi:10.1002/mds.26069
Tamtaji, Omid Reza et al. “Clinical and metabolic response to probiotic administration in people with Parkinson's disease: A randomized, double-blind, placebo-controlled trial.” Clinical nutrition (Edinburgh, Scotland) vol. 38,3 (2019): 1031-1035. doi:10.1016/j.clnu.2018.05.018
Ghaderi, A., Banafshe, H.R., Mirhosseini, N. et al. Clinical and metabolic response to vitamin D plus probiotic in schizophrenia patients. BMC Psychiatry 19, 77 (2019). Doi :10.1186/s12888-019-2059-x
Severance, Emily G et al. “Probiotic normalization of Candida albicans in schizophrenia: A randomized, placebo-controlled, longitudinal pilot study.” Brain, behavior, and immunity vol. 62 (2017): 41-45. doi: 10.1016/j.bbi.2016.11.019
A PROPOS

Estelle Castellanos
Diététicienne-nutritionniste DE
Naturopathe
Fondatrice de la plateforme ATAVI
Santé fonctionnelle
FBCS
Spécialiste des maladies liées aux moisissures
Mycothérapeute certifiée